Comment soigner les Lymphomes / LLC ?
Les lymphomes font partie des cancers que l'on soigne grâce aux traitements modernes telles que la chimiothérapie, la radiothérapie et l'immunothérapie. La réponse aux traitements des différents lymphomes dépend du type et du stade du lymphome, ainsi que d'un certain nombre d'autres facteurs.
Par exemple, un lymphome diffus à grandes cellules B localisé, qui représente un tiers des cas de ce type de lymphome à grandes cellules B, peut être guéri dans 80% des cas. Un lymphome folliculaire étendu est plus difficile à guérir mais demeure compatible avec une survie prolongée.
Beaucoup de patients soignés pour un lymphome sont traités soit par chimiothérapie, radiothérapie ou thérapie biologique, soit par une association de toutes ces thérapies. Une greffe de cellules souches autologues ou allogénique est parfois nécessaire. Sauf cas exceptionnel, la chirurgie n'intervient qu'au moment du diagnostic du lymphome.
La recherche en cours investit des efforts considérables pour évaluer l'efficacité de nouveaux médicaments et d'associations de traitements. En parallèle, les chercheurs tentent de mettre en place de nouveaux protocoles pour minimiser la toxicité à court et moyen terme de ces traitements. Le traitement des lymphomes fait des progrès rapides et de nombreux nouveaux traitements prometteurs sont en cours d'investigation.
En thérapies innovantes, on peut noter l'utilisation des CAR-T Cells. Cette thérapie est prometteuse, mais pour l'instant réservée pour les lymphomes B diffus à grandes cellules, le lymphome médiastinal primitif à grandes cellules B, en rechute et réfractaires ainsi que pour les lymphomes folliculaires et les lymphomes du manteau.
.png)
La Chimiothérapie
La chimiothérapie (souvent appelée " chimio ") est un traitement à base de médicaments. Il existe un nombre important de médicaments utilisés pour détruire les cellules cancéreuses ou pour empêcher leur croissance. Toutefois, il faut noter que la chimiothérapie n'agit pas de manière ciblée sur les cellules cancéreuses et qu'elle peut endommager les cellules saines.
Associations de médicaments utilisées en chimiothérapie
Dans le cadre de la chimiothérapie, plusieurs médicaments sont souvent associés. Ce type de chimiothérapie est appelé protocole de polychimiothérapie. Les médicaments associés ont des modes d'action différents afin d'altérer ou détruire les cellules cancéreuses par divers mécanismes. L'efficacité obtenue est ainsi meilleure.
L'autre raison qui pousse à utiliser une polychimiothérapie est la prévention de la résistance aux médicaments.
Un protocole de chimiothérapie est un programme de traitement qui associe des médicaments anti-cancéreux prescrits à une certaine dose et à un calendrier précis. Il est très important de respecter ce programme autant que possible.
Cycles de chimiothérapie
Une dose unique de chimiothérapie ne peut détruire qu'un certain pourcentage de cellules cancéreuses. Il est donc nécessaire d'administrer des doses multiples afin de les détruire toutes. La chimiothérapie est administrée le plus souvent dans le cadre de cycles ; chaque période de traitement est suivie par une phase de repos et de récupération pendant laquelle aucun médicament n'est administré. Les période de traitement et les intervalles de repos constituent ce que l'on appelle un cycle de chimiothérapie. Les médicaments sont généralement administrés selon un calendrier qui définit précisément l'intervalle qui sépare les périodes de traitement.
Administration de la chimiothérapie
Selon la chimiothérapie retenue, il peut vous être prescrit des médicaments à avaler (sous forme de pilules ou de comprimés) ou qui sont injectés par voie intraveineuse, intramusculaire ou sous-cutanée. Si vous êtes appelé à recevoir votre traitement par voie intraveineuse pendant plusieurs cycles, votre médecin pourra vous recommander l'implantation d'un accès veineux central (souvent appelé cathéter). Il s'agit d'un fin tuyau que l'on insère, au cours d'une brève intervention chirurgicale, dans une veine importante pour faciliter les injections répétées. Il existe différents types d'accès veineux central qui peuvent être implantés de façon provisoire ou permanente.
Pour en savoir plus :
La radiothérapie
La radiothérapie fait appel à des rayons X puissants pour détruire les cellules cancéreuses et réduire les tumeurs. La radiothérapie est une thérapie locale, ce qui veut dire qu'elle n'affecte que les cellules cancéreuses de la zone traitée. Les radiations sont parfois utilisées toutes seules pour certains lymphomes localisés, ganglionnaires ou extraganglionnaires, ou peuvent être associées à une chimiothérapie.
Un champ de radiation est le terme utilisé pour décrire la portion du corps qui est exposé à la radiothérapie. La radiation est généralement concentrée sur les ganglions lymphatiques et les zones qui les entourent ou la région d'origine quand il s'agit d'un lymphome extraganglionnaire. Ces champs sont déterminés au cas par cas et dépendent du type de tumeur et du stade de la maladie.
Pour en savoir plus :
Les effets indésirables de la radiothérapie

Les traitements biologiques
Les thérapies biologiques (dont l'immunothérapie) sont des traitements qui permettent à l'organisme d'utiliser ses propres défenses pour traiter le cancer ou pour atténuer les effets indésirables liés au traitement du cancer. Ces thérapies peuvent stimuler, diriger ou restaurer les défenses naturelles de l'organisme pour lutter contre la maladie. Parmi les thérapies biologiques dirigées contre les tumeurs, on trouve les anticorps monoclonaux, les radioimmunothérapies, les interférons, les vaccins, les thérapies anti-angiogéniques et les thérapies géniques. D'autres thérapies biologiques peuvent également améliorer ou régénérer le nombre de globules rouges et de globules blancs.
Les anticorps monoclonaux et leur mode de fonctionnement
Les cellules plasmatiques, qui sont les cellules B les plus matures de l'organisme, sont des globules blancs spécialisées dans la fabrication des anticorps. Chacune des cellules plasmocitaires est responsable d'un anticorps, aussi connu sous le nom d'anticorps monoclonal (MAb). Chaque MAb agit de façon spécifique contre un antigène spécifique, qui est une sorte d'antenne attirant les anticorps et les cellules immunitaires (telles que les lymphocytes). Grâce aux nouvelles technologies, les scientifiques peuvent désormais produire de larges quantités d'anticorps qui sont dirigés vers un seul antigène présent à la surface d'une cellule. Un MAb est semblable à un missile guidé programmé pour localiser les cellules du lymphome et les détruire.
Rituximab
Rituximab est le premier anticorps monoclonal à avoir reçu une autorisation de mise sur le marché pour le traitement des lymphomes non hodgkiniens à cellules B, CD20 positif, indolent ou folliculaire, en cas de rechutes ou de tumeurs réfractaires. Il prend pour cible l'antigène CD20 que l'on trouve dans presque toutes les cellules B et détruit à la fois les cellules B cancéreuses et les cellules B saines. Il épargne toutes les autres cellules et tissus. Les chercheurs pensent que ce médicament agit en partie grâce à la réponse du système immunitaire l'organisme, réponse qui est activée par les MAbs fixés sur la surface des cellules cancéreuses. Les cellules B immatures (les cellules qui deviendront des cellules B) ne possèdent pas encore d'antigène CD20 et ne sont donc pas affectées. Ainsi, quand le traitement est terminé, l'organisme peut repeupler sa réserve de cellulesLexique B à partir de ces jeunes cellules.
La radioimmunothérapie et son mode de fonctionnement
Les scientifiques sont en train de travailler sur le développement de thérapies qui prennent pour cible les antigènes des cellules cancéreuses. Une des méthodes récemment approuvées fixe une molécule radioactive sur un MAb pour administrer une thérapie de radiation directement sur la tumeur. On pense que les cellules cancéreuses sont attaquées à la fois par le système immunitaire stimulé par le MAb et en permettant une radiation plus concentrée sur la tumeur. Ibritumomab Tiuxetan (Zevalin®) est une radioimmunothérapie approuvée qui consiste à attacher l'isotope Yttrium 90 sur un MAb. Un autre médicament en cours de développement utilise le radioisotope iodine 131 (Bexxar®). Ces approches thérapeutiques sont employées pour le traitement des LNH de type folliculaire de faible grade ou avec des cellules B transformées, en rechute ou réfractaire.
Interféron
L'interféron Alfa est une protéine produite naturellement par l'organisme et dont la fonction est de lutter contre l'invasion de corps étrangers ou de cellules cancéreuses. Il est possible de synthétiser l'interféron pour l'utiliser comme médicament. Il est approuvé pour le traitement de certaines formes de lymphome. Les scientifiques pensent que l'interféron alfa peut détruire les cellules de la tumeur directement et peut également stimuler les cellules saines du système immunitaire afin qu'elles détruisent la tumeur. Certains oncologues recommandent la prise d'interféron comme thérapie de maintien chez les patients en rémission après une chimiothérapie et chez les patients atteints d'un lymphome cutané à cellules T. La plupart des études réalisées jusqu'à présent montrent une amélioration de la longueur de la rémission mais peu d'amélioration au niveau de la durée de vie, sauf pour le lymphomes folliculaires.
Les immunotoxines
Les immunotoxines sont fabriquées en fixant une dose de poison ou toxine à un anticorps ou à un facteur de croissance tel que l'interleukine 2 (IL-2). Les chercheurs veulent évaluer si ce type de thérapie biologique peut être aussi efficace que les MAbs pour détruire des cellules cancéreuses. Ontak (denileukin diftitox), qui comporte une toxine de la diphtérie fixée à l'IL-2, est utilisé dans le traitement des lymphomes cutanés à cellules T.
De nouvelles thérapies biologiques pour l'avenir
Les scientifiques font des recherches avec d'autres traitements biologiques. Parmi eux, on trouve les vaccins, les médicaments anti-angiogéniques, les inhibiteurs de protéasome, la thérapie génique et les molécules antisens et bien sûr les CAR-T cells.
Vaccins
Plusieurs vaccins sont en cours d'évaluation dans le cadre d'essais cliniques. Les vaccins du lymphome sont conçus pour stimuler les défenses naturelles du patient dans la lutte contre sa maladie. Ces vaccins sont faits sur mesure, en utilisant un échantillon de la tumeur qui est prélevée sur un ganglion lymphatique et qui est unique selon le lymphome du patient (idotype). Pour pouvoir fabriquer un vaccin individuel, il est indispensable de pouvoir accéder facilement à un ganglion lymphatique au cours de la biopsie.
Des études préliminaires montrent qu'il existe un effet anti-tumeur chez les patients qui ont été vaccinés, en particulier chez ceux qui ont un cancer de faible malignité ou qui sont en rémission.
Thérapies anti-angiogéniques
Le développement de nouveaux vaisseaux sanguins est appelé angiogénèse. Beaucoup de cancers peuvent stimuler l'angiogénèse et provoquent la formation de nouveaux vaisseaux sanguins. Ces vaisseaux apportent des éléments nutritifs avec le sang et permettent à la tumeur de grandir et de s'étendre. Les thérapies anti-angiogéniques sont conçues pour interrompre le développement de nouveaux vaisseaux sanguins et détruire le réseau anormal de vaisseaux sanguins qui alimentent la tumeur en sang. On pense qu'en prévenant la formation de vaisseaux sanguins, les thérapies anti-angiogéniques peuvent limiter la croissance de certains cancers.
Les inhibiteurs de protéasome
Presque toutes les cellules de l'organisme dégradent régulièrement leurs propres protéines de manière à détruire les protéines abîmées ou anormales et pour contrôler la croissance des cellules et autres procédés vitaux. Un mécanisme cellulaire, qu'on appelle protéasome, dégrade les protéines au cours de ce "ménage" cellulaire. Les scientifiques ont récemment découvert que certaines cellules cancéreuses sont particulièrement vulnérables à une nouvelle classe de molécules que l'on appelle les inhibiteurs de protéasome. Velcade , utilisé dans le traitement d'un cancer de la moelle osseuse appelé myélome multiple, est le premier médicament de ce type approuvé dans le traitement du cancer. Il est aussi connu sous le nom de PS341 ou Bortézomid et, en ce moment, il est en cours d'évaluation pour le traitement du lymphome.
Thérapie génique
Des essais de thérapie génique sont en cours. Les cancers se forment quand des cellules anormales se développent et ne sont pas reconnues ou contrôlées par le système immunitaire du corps. Bientôt, les scientifiques seront peut-être en mesure de concevoir des thérapies moléculaires qui changeront la structure génétique de la tumeur afin que le système immunitaire naturel reconnaisse les cellules cancéreuses comme des corps étrangers. D'autres formes de thérapies géniques rendront les cellules cancéreuses plus sensibles aux effets de la chimiothérapie alors que d'autres encore permettront aux cellules saines d'être moins sensible aux effets de la chimiothérapie.
Molécules antisens
Les médicaments antisens sont des filaments d'acide nucléotide modifiés chimiquement qui interviennent dans le message génétique au cours de la formation d'une protéine. Cette modification peut interférer dans la production des protéines qui sont essentielles à la croissance de la tumeur ou à sa survie.
greffe de moelle osseuse et de cellules souches
La moelle osseuse, cette substance spongieuse situé à l'intérieur des os, contient des cellules immatures, dites cellules souches. Celles-ci donnent naissance à trois types d'éléments cellulaires que l'on retrouve dans le sang : les globules rouges qui distribuent l'oxygène dans tout l'organisme et évacuent le déchet de gaz carbonique ; les globules blancs qui protègent l'organisme des infections ; et enfin les plaquettes qui permettent au sang de se coaguler.
Il est parfois nécessaire de prescrire de très fortes doses de chimiothérapie ou de radiation pour détruire les cellules cancéreuses. Toutefois, au cours de ce processus, les cellules saines de la moelle osseuse sont également détruites. Il est donc nécessaire d'effectuer une greffe de moelle osseuse ou de cellules souches pour retrouver une moelle osseuse saine.
Une greffe peut être très éprouvante pour l'organisme et n'est pas recommandée pour tous les malades. Avant de préconiser une greffe, il faut prendre en considération l'âge du patient, ses antécédents médicaux, le stade du cancer, la réponse aux thérapies précédentes et les chances de succès de la greffe. Actuellement, on réalise plus souvent des greffes de cellules souches plutôt que des greffes de moelle osseuse. En effet, en comparaison avec la greffe de moelle osseuse, la greffe de cellules souches est plus simple à réaliser et l'organisme peut régénérer ses cellules plus rapidement.
Où trouve-t-on de la moelle osseuse et des cellules souches ?
Le succès d'une greffe dépend de la disponibilité des cellules souches. On peut obtenir des cellules souches de deux façons : par une source allogènenique (les patients reçoivent de la moelle osseuse ou des cellules souches d'un donneur, souvent un parent) ou une source autologue, (le patient reçoit ses propres cellules souches). La greffe autologue ou autogreffe de moelle osseuse est plus courante que la greffe allogènique ou allogreffe car elle est moins toxique.
L'allogreffe
Il est primordial de trouver un donneur compatible car votre organisme va rejeter les cellules souches qui seront trop différente des vôtres. Il est également possible que les nouvelles cellules réagissent contre vos cellules, c'est ce qu'on appelle un effet greffon versus hôte (GVH). Il est nécessaire d'effectuer plusieurs tests sanguins pour vérifier que le donneur est compatible. Les meilleurs candidats sont souvent les frères ou les sœurs du patient. L'avantage potentiel d'une allogreffe est que les cellules du système immunitaire du donneur peuvent lutter et détruire les cellules du lymphome.
L'autogreffe
Cette procédure permet au patient de recevoir ses propres cellules souches. L'avantage de ce type de greffe est qu'il n'y a pas de problème de compatibilité et donc aucun risque de rejet ou d'effet GVH.
Pour en savoir plus :
Mini-greffes de moelle osseuse ou de cellules souches (non myéloablative)
Les mini-greffes de moelle ou de cellules souches sont des procédés pour lesquels le patient reçoit de la moelle osseuse ou des cellules souches de la part d'un donneur. Ces procédés sont assez récents et sont donc encore à l'essai. Contrairement aux autres greffes de moelle osseuse ou de cellules souches pour lesquelles il est nécessaire d'administrer de fortes doses de chimiothérapie, dans le cas des mini-greffes le patient reçoit des doses de chimiothérapie plus faibles, en quantité juste suffisante pour que le corps accepte de nouvelles cellules.
Les CAR T Cells
Les CAR-T cells (ou cellules CAR-T) constituent une nouvelle forme d’immunothérapie en plein développement. Elle repose sur la modification génétique des propres lymphocytes T d’un patient afin que ceux-ci soient en mesure de reconnaître et détruire les cellules cancéreuses. Trois médicaments de ce type sont désormais disponibles en France. Le point sur cette approche thérapeutique avec le Pr Catherine Thieblemont, chef du service d’Hématologie de l’Hôpital Saint-Louis à Paris.
Que sont exactement les CAR T Cells
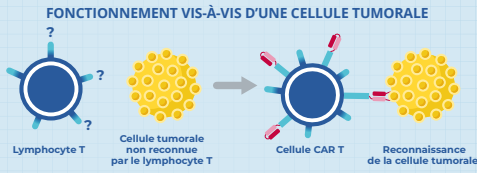
CAR-T cells signifie cellules T à récepteur antigénique chimérique (chimeric antigen receptor). Le principe de cette immunothérapie consiste dans un premier temps à prélever chez un patient des lymphocytes T, des globules blancs qui jouent un rôle majeur au sein du système immunitaire, le système de défense de l’organisme. Ce sont les lymphocytes T qui identifient et détruisent toutes les cellules reconnues étrangères à l’organisme, que ce soient des bactéries, des virus ou des cellules cancéreuses. Les lymphocytes T prélevés sont ensuite modifiés génétiquement pour qu’ils expriment à leur surface une protéine chimérique (c’est-à-dire créée artificiellement) spécifique. Celle-ci leur permet alors de reconnaître les cellules cancéreuses, d’une part, et de s’activer pour détruire ces mêmes cellules cancéreuses. Une fois modifiés, les lymphocytes T sont réinjectés au patient.
.png)
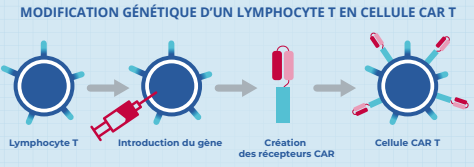
Comment les lymphocytes T sont-ils modifiés ?
.png)
L’objectif est d’introduire au sein du génome des lymphocytes T un nouveau gène qui va conduire les lymphocytes à produire la protéine chimérique souhaitée. Pour cela, plusieurs procédés existent. L’un d’eux consiste à utiliser un virus, lui-même modifié, qui infecte les lymphocytes T et qui introduit dans leur génome le gène de la protéine chimérique. D’autres techniques sont possibles, par exemple de recourir à un outil appelé CRISPR Cas9. Cet outil d’ingénierie du génome permet de couper l’ADN à des endroits précis et d’y introduire des gènes ou d’en inactiver d’autres. Dans le cas présent, on s’en sert pour intégrer le gène de la protéine chimérique.
.png)
La protéine chimérique est-elle la même pour tous les CAR T Cells ?
Non, elle dépend de la maladie ciblée. Pour les lymphomes, jusqu’à présent, c’est une protéine qui cible le récepteur CD19 présent à la surface des lymphocytes B, les cellules à l’origine de la maladie. Pour d’autres hémopathies, la protéine utilisée cible un autre antigène des cellules cancéreuses.
Quelle est l'action de la protéine chimérique ?
Elle se situe de part et d’autre de l’enveloppe du lymphocyte T. Sa partie extérieure permet au lymphocyte de reconnaître le récepteur CD19 des cellules cancéreuses. La partie intérieure a pour mission d’activer le lymphocyte pour qu’il agisse contre les cellules cancéreuses et les détruise.
Quelles sont les molécules CAR T disponibles en 2025 ?
Quatre médicaments par cellules CAR T disposent actuellement d’une autorisation de mise sur le marché (AMM). Ces trois médicaments sont l’axicabtagene ciloleucel (Yescarta®), le tisagenlecleucel (Kymriah®) et le brexucabtagène autoleucel (Tecartus®) et le lisocabtagène maraleucel (Breyanzi®) .
Pour quels types de lymphomes, les médicaments CAR T Cells sont-ils actuellement disponibles ?
Les quatre médicaments par cellules CAR T actuellement disponibles sont utilisés pour le traitement de quatre types de lymphome :
• le lymphome diffus à grandes cellules B* (Yescarta®, Kymriah® et Breyanzi®) ;
• le lymphome folliculaire (Yescarta®, Kymriah® et Breyanzi®) ;
• le lymphome médiastinal primitif à grandes cellules B* (Yescarta® et Breyanzi®) ;
• le lymphome à cellules du manteau* (Tecartus®).
Ces traitements sont destinés à des malades adultes dont le lymphome est considéré être en rechute* ou être réfractaire* après au moins un, deux ou trois lignes de traitement préalables (en fonction des médicaments et des indications).
La possibilité pour un malade d’être traité par cellules CAR T dépend aussi de son état de santé général ; il faut qu’il puisse supporter ce type de traitement.
Comment se déroule concrètement le traitement avec les CAR T Cells ?
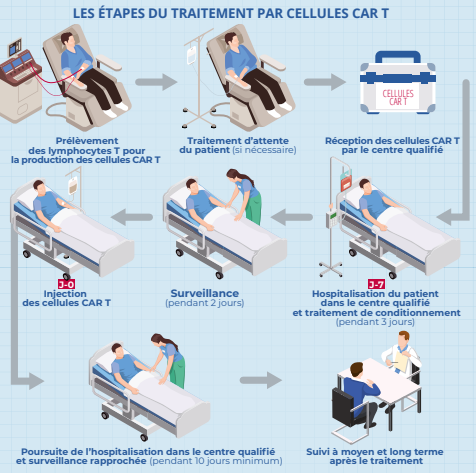.png)
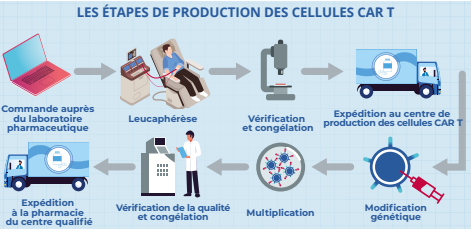
Dans un premier temps, les lymphocytes T du patient sont prélevés par un procédé appelé leucaphérèse. Après un contrôle de leur qualité, ces lymphocytes sont envoyés à un laboratoire spécialisé qui procède à la modification génétique. Les lymphocytes modifiés expriment le nouveau récepteur et se multiplient, toujours en laboratoire. Ils sont ensuite envoyés au centre du patient. Ce dernier reçoit une chimiothérapie pendant trois jours afin d’affaiblir le système immunitaire et limiter le risque de rejet des lymphocytes modifiés. En éliminant une partie des lymphocytes naturels de l’organisme, cette chimiothérapie vise également à favoriser la multiplication des lymphocytes modifiés. Ceux-ci sont alors administrés au patient au cours d’une unique perfusion. Le patient reste hospitalisé pendant au moins une dizaine de jours pour être surveillé de façon très rapprochée.
Quel est le délai nécessaire pour obtenir les CAR T Cells ?
Aux États-Unis, le délai entre la collecte et la réinjection des lymphocytes T est actuellement de 17 jours. Dans notre expérience à l’hôpital Saint-Louis, le délai entre la validation de l’ATU et la réception des cellules dans les hôpitaux est de 45 jours en médiane, avec des extrêmes allant de 29 à 129 jours. Les lymphocytes sont actuellement tous modifiés aux États-Unis. Pour des patients dont la maladie est très agressive, de tels délais sont un réel problème. Deux patients sont d’ailleurs décédés dans le service avant d’avoir pu recevoir leurs CAR-T cells ! Les laboratoires qui produisent ces médicaments sont en train d’ouvrir des plateformes de production en France et dans des pays limitrophes. J’espère que cela permettra de réduire les délais prochainement.
Quelle est l'efficacité obtenue actuellement avec ces traitements ?
Les essais cliniques menés jusqu’à présent avec les deux médicaments par cellules CAR T actuels pour le traitement des lymphomes diffus à grandes cellules B ont mis en évidence :
• Des taux de réponse globale de 53 % et 85 % ;
• Des taux de réponse complète (rémission*) de 40 % et 74 %.
• Des rémissions* prolongées ont été observées chez certains patients.
Les études réalisées en "vie réelle" c'est-à-dire chez les patients traités en dehors des essais thérapeutiques, montrent des résultats similaires.
Ces résultats montrent cependant que les cellules CAR T ne sont pas systématiquement efficaces ; des échecs et des rechutes* peuvent survenir.
Quels sont les principaux effets indésirables associés aux CAR T Cells ?
Ce ne sont pas des médicaments anodins, la quasi-totalité des patients traités présentent des effets indésirables sérieux. Deux effets indésirables très spécifiques surviennent à court terme. Il y a d’abord ce que l’on appelle le syndrome de relargage cytokinique, qui se produit le plus souvent trois à neuf jours après l’injection des lymphocytes modifiés. Ceux-ci entraînent, par réaction du système immunitaire, une grande production de cytokines, des substances qui servent à la communication entre les cellules Cela provoque des symptômes tels que de la fièvre, des frissons, une hypotension, des vertiges, des maux de tête. Ce syndrome peut s’accompagner aussi d’une insuffisance rénale, hépatique, pulmonaire ou cardiaque parfois sévère, pouvant mettre en jeu le pronostic vital. Des effets indésirables neurologiques peuvent également se produire, en général plutôt à partir du 5e jour après l’administration des CAR-T cells. Ce sont par exemple des convulsions, des tremblements, des états de confusion, des difficultés d’élocution, des pertes de connaissance. Enfin, la chimiothérapie pré-injection entraîne une aplasie, avec un risque d’infection grave. La surveillance des patients après le traitement par CAR-T cells est très rigoureuse, en lien avec une équipe de réanimation. C’est pour cette raison que seuls des centres agréés sont aujourd’hui autorisés à administrer ces médicaments. Il faut que les médecins et le personnel soignant soient formés et disposent des ressources nécessaires pour la surveillance et la prise en charge des patients.
Quels sont les principaux actes de recherches actuels sur les CAR T Cells ?
La recherche sur les cellules CAR T est très active. Alors que les traitements de ce type actuellement disponibles sont de 2e génération, des cellules CAR T de 3e génération sont en phase d’évaluation chez des patients. D’autres, de 4e génération, sont en cours d’élaboration en laboratoire. Avec ces nouvelles générations, davantage de modifications sont apportées aux lymphocytes* T, l’objectif étant d’améliorer leur activation et leur activité contre les cellules tumorales.
En parallèle, des recherches sont menées sur des cellules CAR T dites « bispécifiques », c’est-àdire qui expriment deux récepteurs* à l’antigène* (CAR). Le but est d’améliorer la reconnaissance des cellules tumorales et de prévenir des phénomènes de résistance*. Des études ont en effet montré que les cellules tumorales parviennent parfois à ne plus exprimer l’antigène* reconnu par les cellules CAR T. Celles-ci deviennent en quelque sorte « aveugles » : elles ne peuvent plus reconnaître les cellules tumorales et donc agir contre elles. Ces phénomènes de résistance* peuvent expliquer en partie les situations d’échec ou de rechute* observées chez des patients traités par cellules CAR T.
Enfin, des cellules CAR T sont évaluées contre d’autres types de lymphome afin de savoir si elles pourront être proposées à davantage de malades.
Les essais en cours sur des cellules CAR T sont présentés sur la plateforme ORELy
Les centres agréés en France
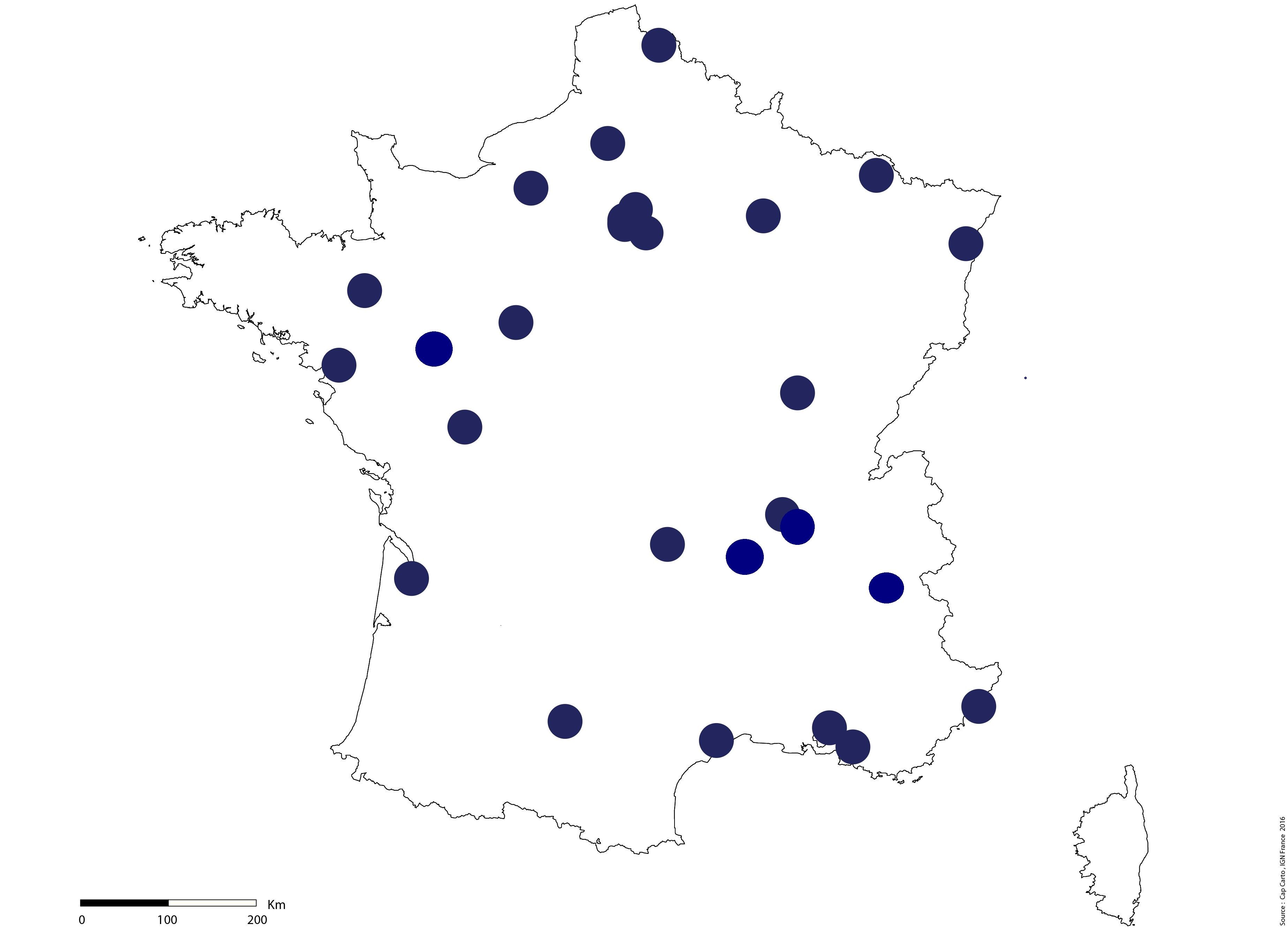
À l’heure actuelle (juin 2025), les centres agréés en France pour délivrer les CAR T Cells (hors essais cliniques) sont : Les CHU d'Amiens, Angers, Besancon, Bordeaux, Brest, Clermont Ferrand, Créteil Henri Mondor, Dijon, Grenoble, Lille, Limoges, Nancy, Nantes, Nice, Montpellier, Poitiers, Reims, Rennes, Rouen, Strasbourg (ICANS), Tours. Le centre hospitalier de Lyon-Sud ainsi que le Centre Léon Bérard, à Marseille l’Institut Paoli Calmettes et La Timone (Pédiatrie), le centre Henri Becquerel de Rouen, l'institut d'hématologie de basse Normandie à Caen, l'institut de Cancérologie de St Etienne (ICHUSE), l’Oncopole de Toulouse et l’Institut Gustave Roussy à Villejuif et à Paris : L’hôpital Saint Louis, l'hôpital Cochin, l’hôpital de la Pitié Salpêtrière et l’hôpital Saint Antoine, l'hôpital Necker, l'hôpital Robert Debré (Pédiatrie) et le HIA Percy.
Selon un arrêté du 8 août 2019, modifiant l’arrêté du 28 mars 2019, le traitement doit se faire dans un centre qualifié, autorisé à prélever les lymphocytes T et à administrer les cellules CAR-T. Les établissements de santé qui utilisent les cellules CAR-T doivent également se déclarer auprès de l’ARS territoriale compétente. Article
Congrés Cell Innovation Therapy 360°
(Mai 2019)
- Dr Emmanuel Bachy - CH Lyon-Sud
Congrès de American Society of Hematology (Décembre 2018) - Pr Roch Houot - CHU de Rennes
Congrès de l'American Society oh Hematology (Décembre 2018) - Pr Catherine Thieblemont - Hôpital Saint Louis - Paris
.png)
Immunothérapie par cellules CART : Comprendre votre traitement
Edition Mars 2024
Immunothérapie par cellules CAR T : Comprendre votre traitement
Les médicaments biosimilaires
Qu'est ce qu'un médicament biosimilaire ?
Un médicament biologique est un médicament élaboré à partir d’organismes vivants. La plupart des médicaments biologiques sont des protéines complexes, avec une structure particulière dans l’espace permettant de garantir leur efficacité.
Les médicaments biologiques, tels que les vaccins, existent depuis très longtemps. Des thérapies innovantes comme les anticorps monoclonaux sont également des médicaments biologiques et sont disponibles depuis les années 90.
Un médicament biologique similaire (biosimilaire) est un médicament biologique de même composition qualitative et quantitative en substance active et de même forme pharmaceutique qu’un médicament biologique de référence. Le médicament biosimilaire n’est pas une copie parfaite du médicament biologique de référence, mais leurs différences sont mineures. Les deux médicaments fonctionnent de la même manière et ont une structure très semblable. Le biosimilaire est aussi efficace que le médicament de référence et a les mêmes effets.
Quel est le principe d'action des médicaments biosimilaires ?
Il ne faut pas confondre les médicaments biosmilaires avec les médicaments génériques, qui sont eux produits par chimie (ex : l’aspirine). Les médicaments biologiques sont issus du vivant et sont complexes. Il n’est donc pas possible de les reproduire de manière strictement exacte en raison de différences liées notamment à la variabilité de la matière première ou aux procédés de fabrication. Il peut ainsi exister des différences mineures entre plusieurs lots d’un même médicament biologique. Un médicament biosimilaire est donc très proche, mais pas exactement identique, au médicament biologique de référence. Cette variabilité est si infime qu’elle n’a pas d’impact sur les caractéristiques et l’action du médicament biosimilaire.
Les modalités d’un traitement par biosimilaire (doses, voie et fréquence d’administration, rythme de la surveillance) sont identiques à celles d’un traitement par le médicament biologique de référence.
Quel est l'intérêt des médicaments biosimilaires ?
Les biosimilaires présentent un intérêt financier pour le système de santé. En effet, le coût moins élevé des biosimilaires contribue à l’équilibre économique de notre système de santé et permet, en contrepartie, de financer la prise en charge de thérapies innovantes coûteuses.
Pour en savoir plus :









.png)
.png)
.png)



.png)
.png)
.png)

